5.3.6 Нейроморфные системы типа I. Исследования мозга и принцип STDP
Конечно, успехи, достигнутые в области обучения традиционных искусственных нейронных сетей при помощи метода обратного распространения ошибки, создают соблазн применить этот же метод при обучении импульсных сетей. Импульсная версия метода обратного распространения ошибки показала свою жизнеспособность — сегодня импульсные сети, обученные при помощи этого метода, лишь незначительно уступают в точности традиционным нейронным сетям.
Однако для достоверной симуляции мозга нужно использовать методы, аналогичные тому, что происходит собственно в мозге. Одна из проблем заключается в том, что современной науке неизвестны бесспорные физиологические аналоги метода обратного распространения ошибки. Если вам хочется позлить нейрофизиолога, заведите с ним дискуссию о методе обратного распространения ошибки в мозге, но хочу сразу предупредить, что за последствия этой авантюры я не несу никакой ответственности. Ввиду этого пришлось искать для обучения импульсных сетей методы, для которых всё-таки обнаруживаются аналоги в физиологии. В конечном счёте эта одиссея завершилась успехом, и сегодня таковые нам известны. Более того, выяснилось, что в ряде экспериментов они не слишком уступают методу обратного распространения ошибки[1], а при правильно подобранных параметрах могут оказаться даже более эффективными.
В первую очередь речь идёт о процессе, получившем название «синаптическая пластичность, зависящая от времени импульса» (Spike-timing-dependent plasticity, STDP). Это биологический процесс, который регулирует силу связей между нейронами на основе относительной синхронизации входного и выходного потенциалов конкретного нейрона.
Сам термин «синаптическая пластичность» был введён польским психиатром и нейрофизиологом Ежи Конорским для обозначения долгосрочных изменений эффективности синаптических связей в результате кратковременных изменений синаптической активности. В настоящее время значение этого термина расширилось и теперь включает не только изменение эффективности, но также вырастание новых и активацию ранее неактивных синапсов[2].
В чём же особенность такого механизма синаптической пластичности, как STDP?
Если импульсы, поступающие через некоторый входной синапс нейрона, имеют тенденцию возникать непосредственно перед срабатыванием нейрона, то этот конкретный синапс получает положительное подкрепление, усиливающее соответствующую связь. Если же входные импульсы имеют тенденцию возникать уже после срабатывания нейрона, то соответствующий входной синапс получает отрицательное подкрепление и соответствующая синаптическая связь ослабляется. Нетрудно заметить, что STDP является дальнейшим развитием идеи хеббовского обучения.
Уже полстолетия назад большинство нейробиологов считало утверждение о том, что синаптическая пластичность обеспечивает физиологическую основу для обучения и памяти, практически самоочевидным. Но, несмотря на почти всеобщее признание этой точки зрения, экспериментальных доказательств было найдено не так уж много. Одним из первых стала новаторская работа[3] Эрика Кандела, опубликованная в 1965 г. В ней Канделу и его коллегам удалось продемонстрировать прямую связь между синаптической пластичностью и изменением поведения морского беспозвоночного Aplysia californica.
В 1973 г. канадский исследователь Морис Тейлор предположил, что если бы синапсы, для которых импульс предшествующего нейрона (пресинаптический) чаще происходил непосредственно перед импульсом следующего нейрона (постсинаптическим), усиливались (хеббовское обучение), а синапсы, для которых это условие не соблюдалось, — ослаблялись (антихеббовское обучение), то данный механизм позволил бы объяснить эффективное кодирование образов мозгом[4]. Однако работа Тейлора, как и диссертация Вербоса, не была в то время замечена коннекционистским сообществом.
Процесс, соответствующий хеббовскому обучению в биологических и импульсных нейронных сетях, в наши дни обычно называют долговременной потенциацией (ДВП, Long-term potentiation, LTP), а антихеббовскому обучению — долговременной депрессией (ДВД, Long-term depression, LTD).
Долговременная потенциация в живом организме открыта норвежским учёным Терье Лёмо в 1966 г. в ходе опытов на гиппокампе кроликов. Первая научная статья с описанием процесса ДВП опубликована[5] Лёмо совместно с британским нейробиологом Тимоти Блиссом в 1973 г.
Хотя Лёмо и Блиссу и удалось обнаружить само явление долговременной потенциации, скудность экспериментальных данных не позволила им с уверенностью говорить о конкретных биохимических механизмах, лежащих в основе этого эффекта. Однако ряд важных предположений, подтвердившихся в будущем, они всё же сделали. Для того чтобы лучше понять их, давайте более подробно рассмотрим устройство синапса.
Как мы уже знаем, нервные клетки имеют обычно несколько отростков. Напомним, что разветвлённые тонкие отростки нейронов называются дендритами. Именно дендрит является «входом» нейрона, через который он получает электрические импульсы от других клеток. Если рассмотреть дендрит типичного нейрона под микроскопом, на нём можно заметить множество коротких отростков (обычно грибовидной формы), называемых «дендритными шипиками» [spines]. Тонкая ножка шипика называется «дендритной шейкой» [spine neck], а утолщение на конце шипика — «головкой» [spine head]. Вообще говоря, дендритные шипики не всегда имеют грибовидную форму. Специалисты по морфологии нейронов способны разглядеть, помимо грибовидных шипиков, также «протошипики», «тонкие шипики», «пеньковые шипики», «разветвлённые шипики» и даже загадочные «филоподии», но мы постараемся всё-таки избежать погружения в пучины знаний о дендритных шипиках. Достаточно отметить, что большая часть синапсов расположена именно на них.
Синаптическая щель разделяет участки мембран (оболочек) двух нейронов. При этом участок мембраны со стороны аксона называется пресинаптической мембраной, а со стороны дендрита — постсинаптической. Синапсы разделяют на электрические и химические. Электрические синапсы характеризуются очень узким просветом между пресинаптической и постсинаптической мембранами (менее 4 нм) и наличием специальных каналов, пересекающих обе мембраны. Через эти каналы клетки могут обмениваться ионами и небольшими молекулами. Электрические синапсы способны очень быстро передавать сигнал, но не способны усиливать его. Электрические синапсы обычно двунаправленны, то есть нервный импульс может проходить по ним в обоих направлениях. Но нас больше интересуют более сложные, химические синапсы. Зазор между пресинаптической и постсинаптической мембранами в них может составлять порядка 20–40 нм. Постсинаптическая мембрана химического синапса оснащена набором рецепторов — белковых структур, реагирующих на присоединение к ним молекул определённого химического вещества и вызывающих в результате этого некоторые изменения внутри клетки. Самый распространённый способ вызвать эти изменения используют так называемые ионотропные рецепторы, открывающие в ответ на присоединение к ним определённой молекулы ионный канал, что приводит к возникновению перетока ионов сквозь постсинаптическую мембрану.
Мы не будем углубляться в разновидности рецепторов (их десятки) и детали их работы (они весьма поучительны и разнообразны) и отметим лишь, что в соответствии с доминирующими в наши дни представлениями наиболее важную роль в ДВП играют так называемые NMDA-рецепторы (ионотропные рецепторы глутамата, связывающие N-метил-D-аспартат). Это довольно интересные молекулярные машины, в основе работы которых лежит несколько занятных химических механизмов. В неактивированной форме канал рецептора закрыт ионом магния или цинка. Они покидают просвет канала при деполяризации постсинаптической мембраны. Для того чтобы ионный канал начал функционировать, две молекулы глутамата (глутаминовой кислоты, также называемой 2-аминопентандиовой кислотой) из синаптической щели должны соединиться со специальным участком рецептора (так называемым участком (сайтом) связывания глутамата [glutamate binding site]), а две молекулы глицина, или D-серина, должны соединиться с участком связывания глицина. В открытом состоянии канал, при наличии соответствующей разницы потенциалов, допускает приток положительно заряженных ионов натрия (а также, в небольших количествах, кальция) в клетку и отток из неё положительно заряженных ионов калия.
Во времена исследований Лёмо и Блисса NMDA-рецепторы были известны науке лишь в роли теоретической концепции. Гипотезу об их существовании выдвинули в 1960 г. нейробиологи Джеффри Уоткинс и Дэвид Кёртис. Сам Уоткинс называл эти времена «тёмными веками» [dark ages] в исследовании роли глутамата в мозге. Тогда лишь немногие учёные всерьёз относились к гипотезе о том, что эта аминокислота может выполнять роль химического посредника в передаче нервных импульсов (так называемого нейротрансмиттера). Вполне вероятно, что Лёмо и Блисс в те годы могли не знать о существовании такой гипотезы. Рассуждая о механизмах, стоящих в основе увеличения пропускной способности синаптических связей, они сделали предположение, что в её основе могут лежать следующие механизмы.
- Окончание аксона часто распадается на тонкие веточки, называемые телодендриями, которые заканчиваются специализированными нервными окончаниями, называемыми терминалями. Увеличение количества терминалей, через которые распространяется импульс, Лёмо и Блисс рассматривали в качестве первой возможности для увеличения пропускной способности нервного пути в процессе ДВП.
- Увеличение количества нейротрансмиттера, поступающего в соответствующие синаптические щели. Лёмо и Блисс при этом не строили никаких гипотез в отношении того, о каком именно нейротрансмиттере идёт речь.
- Увеличение чувствительности постсинаптической мембраны.
- Увеличение проводимости дендритных шеек. Саму идею о том, что изменение проводимости дендритных шеек лежит в основе изменения синаптических весов, высказали[6] за два года до Лёмо и Блисса Уилфред Ролл и Джон Ринцель. Сегодня их имена увековечены в названиях ряда моделей биологического нейрона, таких как модель Ролла (другое название кабельной теории дендритов), модель Фитцхью — Ринцеля (FitzHugh—Rinzel, FH-R) (усовершенствованная версия модели Фитцхью — Нагумо)[7], а также модель Пинского — Ринцеля (нелинейная двухкомпартментная модель пирамидальных клеток CA3)[8].
Лёмо и Блисс писали, что у них нет доказательств, позволяющих предпочесть один из четырёх описанных выше механизмов. Интересно, что современные научные данные свидетельствуют в пользу того, что задействованы все четыре. Первый связан с прорастанием новых дендритных шипиков, что приводит к росту числа синаптических контактов[9], [10]. Второй — с увеличением числа везикул (крошечных внеклеточных пузырьков), содержащих нейротрансмиттеры, и вероятности их высвобождения в синаптическую щель[11]. Третий связан с увеличением количества рецепторов на постсинаптической мембране, а также ростом их активности[12], [13]. Причём речь не только о NMDA-рецепторах, но и о других рецепторах глутамата, таких как ионотропные АМРА-рецепторы (рецепторы α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты)[14] и метаботропные глутаматные рецепторы (mGluR)[15]. Последние, в отличие от «быстродействующих» ионотропных рецепторов, обеспечивают медленную реакцию на опосредованные глутаматом (глутаматергические) сигналы. Они активируют внутриклеточные сигнальные реакции, ведущие к модификации других белков, например тех же ионных каналов. Четвёртый механизм связан с изменением морфологии дендритных шеек[16].
Ажиотаж, вызванный открытием синаптической пластичности в гиппокампе, вызвал настоящую лавину исследований. Дуглас и Годдард в 1975 г. показали[17], что быстро повторяющиеся импульсы были более эффективными в вызове (индукции) ДВП, чем одиночное длинное (так называемое тетаническое) возбуждение. Это было важной вехой в истории изучения синаптической пластичности не только потому, что повторяющиеся короткие импульсы стали популярным способом для вызова ДВП, но также и потому, что была продемонстрирована важность повторных и постоянных периодов стимуляции для индукции ДВП, что вполне подтверждало догадки Хебба и других пионеров нейрофизиологии. Дуглас и Годдард также ввели сам термин ДВП (LTP), отталкиваясь от предложения Пера Андерсена. Множество экспериментальных и теоретических исследований, вызванных к жизни новыми открытиями, было направлено на то, чтобы проверить различные аспекты постулата Хебба и выявить конкретные механизмы, лежащие в основе синаптической пластичности. Активные споры велись по поводу того, лежат ли в её основе пре- или постсинаптические изменения или же синапсы могут изменяться разными способами.
Следующий важный шаг в расширении знаний о синаптической пластичности сделал Брюс Макнафтон, будущий научный руководитель будущего нобелевского лауреата Эдварда Мозера, подарившего нам знание о «нейронах решётки» (системе клеток в мозге, которая позволяет ориентироваться в пространстве). Макнафтон показал, что в случае одновременной тетанической стимуляции двух нервных путей может происходить ДВП, которая не происходит при их неодновременной стимуляции аналогичными импульсами («нервный путь», или «проводящий путь» [neural pathway], — цепочка нейронов, обеспечивающая проведение одинаковых нервных импульсов в определённом направлении). Данный эффект обусловлен совместным действием нервных путей[18]. Это стало важным подтверждением идеи Хебба о клеточных ансамблях, в которых возбуждение одного нейрона приводит в возбуждение весь ансамбль и благодаря которым компоненты воспоминания могут усиливать друг друга и даже укреплять другие связанные воспоминания. Макнафтон и его соавторы были также, вероятно, первыми, кто экспериментально исследовал важность нахождения постсинаптического и пресинаптического импульсов в близком временном интервале.
Примерно в это же время Гэри Линч и его коллеги обнаружили явление ДВД в гиппокампе: в то время как тетаническая стимуляция вызывала ДВП активированного нервного пути, неактивированный нервный путь подвергался ДВД (гетеросинаптическая ДВД)[19]. Кроме того, они обнаружили, что ДВД постепенно происходит и в самом активированном нервном пути, если он редко подвергается активации (гомосинаптическая ДВД)[20]. В психологическом плане это явление можно рассматривать как нейронный механизм постепенного угасания воспоминаний[21].
В 1982 г. в работе[22] Масао Ито и его коллег было показано существование гетеросинаптической ДВД параллельных волокон в мозжечке, вызываемой их одновременной активацией. Некоторые исследователи в наши дни считают, что параллельные волокна передают в обратном направлении сигналы для коррекции эффективности синапсов. Не забудьте упомянуть эту работу, когда будете троллить знакомого нейрофизиолога вопросом о наличии в мозге механизма для обратного распространения ошибки. К слову сказать, мозжечок является очень важной частью нервной системы. Хотя он занимает у человека всего около 10% объёма головного мозга, на долю этого отдела приходится около 80% его нейронов![23] В соответствии с современными научными представлениями в хитросплетениях связей нервных клеток мозжечка закодированы модели всего, с чем на протяжении жизни сталкивается двигательная система организма[24], [25].
В 1983 г. Освальд Стюарт и Уильям Леви исследовали[26] влияние на синаптическую пластичность относительной синхронизации в пределах нескольких миллисекунд потенциалов пре- и постсинаптического действия. Для этого они взяли два нервных пути, оканчивающихся в одном постсинаптическом нейроне, — «слабый» и «сильный», то есть с меньшей эффективностью и с большей, — и вызывали в них стимулы, варьируя время вызова импульса. Хотя им и удалось обнаружить в опытах существенную асимметрию: активация слабого нервного пути раньше сильного вызывала ДВП в слабом нервном пути, в то время как активация сильного нервного пути раньше слабого вызывала ДВД в слабом нервном пути, но авторы, как и многие другие исследователи в 1980-е гг., не усмотрели в этом явлении системы.
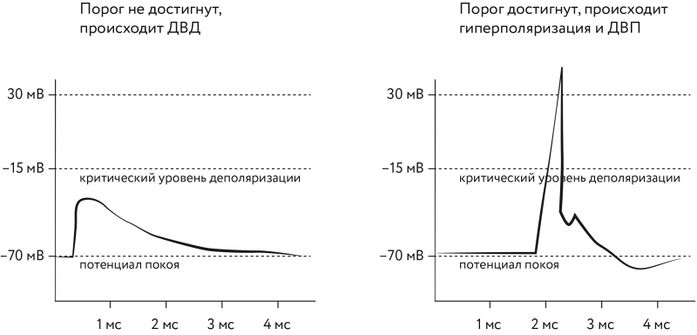
В 1990 г. немецкий исследователь Вольф Зингер и его коллеги сообщили[27], что наступление ДВП или ДВД обусловлено гиперполяризацией или деполяризацией постсинаптического нейрона (напомним, что гиперполяризация — это смещение мембранного потенциала относительно потенциала покоя в более отрицательную сторону, а деполяризация — в положительную). ДВП происходит, если после стимуляции мембранный потенциал постсинаптического нейрона не достигает определённого порога («критический уровень деполяризации»), а ДВП происходит, если данный порог достигается, ввиду чего происходит последующая гиперполяризация.
Рис. 115. Зависимость мембранного потенциала от времени,
прошедшего после стимуляции
Это исследование привлекло внимание к более пристальному изучению постсинаптического нейрона, поскольку именно его мембранный потенциал является ключевым для ДВП или ДВД, которые необязательно зависят от поступления сигнала через входящий синапс[28]. Четырьмя годами спустя Доминик Дебанн и его коллеги сделали[29] ещё один шаг вперёд: они вначале направляли деполяризующие импульсы тока непосредственно в постсинаптический нейрон, меняя его мембранный потенциал, а потом стимулировали нервный путь. Их исследования показали, что при небольшой разнице по времени между искусственной деполяризацией и входными импульсами происходит ДВП, а при большой — ДВД. Это добавило к исследованию Зингера тот факт, что именно уровень деполяризации и гиперполяризации, вызванный каким-либо образом (даже искусственно), и определяет направление синаптической пластичности.
Наконец, в 1991 г. Роберто Малиноу провёл завершающее исследование. Он смог в тонком срезе гиппокампа выделить четыре пары пирамидальных нейронов CA3 и CA1, каждая из которых была связана через единственный синапс. Затем он, одновременно вызывая серии импульсов в пре- и постсинаптическом нейронах, получил ДВП в этих соединениях[30]. Эта работа стала первой (спустя более сорока лет после выхода в свет ключевой работы Хебба!) прямой демонстрацией того, что синаптические связи между двумя нейронами могут изменяться, ведь здесь удалось полностью исключить влияние на ход эксперимента сторонних воздействий.
В наши дни продолжается активное изучение биологических механизмов, лежащих в основе ДВП и ДВД. В частности, учёные вырабатывают подходы, позволяющие рассчитывать эффективность каждого отдельно взятого синапса на основе данных микроскопии[31], [32], [33].
Важной вехой в истории изучения механизмов ДВП и ДВД стало выступление Генри Маркрама на ежегодном собрании Общества нейронаук (Society for Neuroscience) в 1995 г. В ходе этого выступления Маркрам рассказал научной общественности о первом экспериментальном исследовании[34], показавшем, что ДВП и ДВД зависят от разницы во времени возникновения одиночных импульсов, испускаемых пре- и постсинаптическими нейронами в моносинаптических связях между парами нейронов неокортекса. Водораздел, задаваемый относительной синхронизацией отдельных импульсов на временно́м масштабе в несколько десятков миллисекунд, определял направление (потенциация или депрессия) и степень изменения эффективности синаптической связи. Именно это выступление Маркрама (ныне директора Blue Brain Project и основателя Human Brain Project) стало моментом окончательного оформления STDP в качестве модели синаптической пластичности биологических нейронов и одновременно как алгоритма обучения импульсных нейронных сетей[35], хотя сам термин STDP появился только в 2000 г. в работе[36] Сена Сонга, Кеннета Миллера и Ларри Эбботта. Таким образом, спустя полстолетия после основополагающей работы Хебба его знаменитое «возбуждаются вместе — связываются вместе» [fire together, wire together] (соответствующее ДВП), как оказалось, можно дополнить ещё одним принципиальным афоризмом, предложенным Карлой Шатц: «Сработал несинхронно — потерял свою связь» [fire out of sync, lose your link][37] (соответствующее ДВД).
Важными параметрами STDP являются конкретные значения временных интервалов синхронизации импульсов. В ходе экспериментов по обучению больших импульсных сетей для решения прикладных задач были созданы такие методы, как R-STDP (версия STDP, в которой обучение модулируется при помощи внешнего подкрепления, основанного на фазовой активности дофаминовых нейронов)[38], TD-STDP (версия STDP, использующая метод временных разниц [temporal difference])[39] и даже BP-STDP, а также другие похожие методы, эмулирующие работу метода обратного распространения ошибки за счёт особого подбора параметров STDP[40], [41], [42]. Эти методы для ряда задач демонстрируют эффективность, сходную с эффективностью метода обратного распространения ошибки[43], [44], [45].
- ↑ Illing D., Gerstner W., Brea J. (2019). Biologically plausible deep learning — But how far can we go with shallow networks? / Neural Networks, Vol. 118, pp. 90—101 // https://doi.org/10.1016/j.neunet.2019.06.001
- ↑ Bliss T. V. P. (1979). Synaptic plasticity in the hippocampus / Trends in Neurosciences, Vol. 2, pp. 42—45 // https://doi.org/10.1016/0166-2236(79)90019-5
- ↑ Kandel E. R., Tauc L. (1965). Heterosynaptic facilitation in neurones of the abdominal ganglion of Aplysia depilans / The Journal of Physiology, Vol. 181, Iss. 1, pp. 1—27 // https://doi.org/10.1113/jphysiol.1965.sp007742
- ↑ Taylor M. M. (1973). The Problem of Stimulus Structure in the Behavioural Theory of Perception / South African Journal of Psychology, Vol. 3, pp. 23—45 // https://www.researchgate.net/publication/298214719_The_Problem_of_Stimulus_Structure_in_the_Behavioural_Theory_of_Perception
- ↑ Bliss T. V., Lomo T. (1973). Long-lasting potentiation of synaptic transmission in the dentate area of the anaesthetized rabbit following stimulation of the perforant path / The Journal Of Physiology, Vol. 232, No. 2, pp. 331—356 // https://doi.org/10.1113/jphysiol.1973.sp010273
- ↑ Rall W., Rinzel J. (1971). Dendritic spine function and synaptic attenuation calculations / Program and Abstracts: Society for Neuroscience First annual meeting, p. 64
- ↑ Zemlyanukhin A. I., Bochkarev A. V. (2019). Analytical Properties and Solutions of the FitzHugh—Rinzel Model / Russian Journal of Nonlinear Dynamics, 2019, vol. 15, no. 1, pp. 3–12 // https://doi.org/10.20537/nd190101
- ↑ Rahimian E., Zabihi S., Amiri M., Linares-Barranco B. (2017). Digital Implementation of the Two-Compartmental Pinsky-Rinzel Pyramidal Neuron Model / IEEE Transactions on Biomedical Circuits and Systems, 2018-Feb; 12(1):47-57 // https://doi.org/10.1109/TBCAS.2017.2753541
- ↑ Lynch M. A. (2004). Long-term potentiation and memory / Physiological Reviews, Vol. 84, Iss. 1, pp. 87—136 // https://doi.org/10.1152/physrev.00014.2003
- ↑ Segal M., Murphy D. D. (1999). CREB activation mediates plasticity in cultured hippocampal neurons / Neural Plasticity, Vol. 6, Iss. 3, pp. 1—7 // https://doi.org/10.1155/NP.1998.1
- ↑ Emptage N. J., Reid C. A., Fine A., Bliss T. V. (2003). Optical quantal analysis reveals a presynaptic component of LTP at hippocampal Schaffer-associational synapses / Neuron, Vol. 38, Iss. 5, pp. 797—804 // https://doi.org/10.1016/S0896-6273(03)00325-8
- ↑ Tang Y. P., Shimizu E., Dube G. R., Rampon C., Kerchner G. A., Zhuo M., Liu G., Tsien J. Z. (1999). Genetic enhancement of learning and memory in mice / Nature, Vol. 401 (6748), pp. 63—69 // https://doi.org/10.1038/43432
- ↑ Tang Y., Wang H., Feng R., Kyin M., Tsien J. (2001). Differential effects of enrichment on learning and memory function in NR2B transgenic mice / Neuropharmacology, Vol. 41, Iss. 6, pp. 779—790 // https://doi.org/10.1016/S0028-3908(01)00122-8
- ↑ Malinow R. (2003). AMPA receptor trafficking and long-term potentiation / Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, Vol. 358 (1432), pp. 707—14 // https://doi.org/10.1098/rstb.2002.1233
- ↑ Malenka R. C., Bear M. F. (2004). LTP and LTD: an embarrassment of riches / Neuron, Vol. 44, Iss. 1, pp. 5—21 // https://doi.oeg/10.1016/j.neuron.2004.09.012
- ↑ Araya R., Vogels T. P., Yuste R. (2014). Activity-dependent dendritic spine neck changes are correlated with synaptic strength // PNAS, Vol. 111, Iss. 28, pp. E2895—E2904 // https://doi.org/10.1073/pnas.1321869111
- ↑ Douglas R. M., Goddard G. V. (1975). Long-term potentiation of the perforant path-granule cell synapse in the rat hippocampus / Brain Research, Vol. 86, Iss. 2, 21-Mar-1975, pp. 205—215 // https://doi.org/10.1016/0006-8993(75)90697-6
- ↑ McNaughton B. L., Douglas R. M., Goddard G. V. (1978). Synaptic enhancement in fascia dentata: cooperativity among coactive afferents / Brain Research, 1978 Nov 24; 157(2):277-93 // https://doi.org/10.1016/0006-8993(78)90030-6
- ↑ Lynch G. S., Dunwiddie T., Gribkoff V. (1977). Heterosynaptic depression: a postsynaptic correlate of long-term potentiation / Nature, Vol. 266, pp. 737—739 // https://doi.org/10.1038/266737a0
- ↑ Dunwiddie T., Lynch G. (1978). Long-term potentiation and depression of synaptic responses in the rat hippocampus: localization and frequency dependency / The Journal of Physiology, Vol. 276, pp. 353—367 // https://doi.org/10.1113/jphysiol.1978.sp012239
- ↑ Markram H., Gerstner W., Sjöström P. J. (2011). A history of spike-timing-dependent plasticity / Frontiers in synaptic neuroscience, 3, 4 // https://doi.org/10.3389/fnsyn.2011.00004
- ↑ Ito M., Sakurai M., Tongroach P. (1982). Climbing fibre induced depression of both mossy fibre responsiveness and glutamate sensitivity of cerebellar Purkinje cells / The Journal of Physiology, Vol. 324, pp. 113—134 // https://doi.org/10.1113/jphysiol.1982.sp014103
- ↑ Herculano-Houzel S. (2009). The Human Brain in Numbers: A Linearly Scaled-up Primate Brain / Frontiers in Human Neuroscience, Vol. 3, Iss. 21, 2009 // https://doi.org/10.3389/neuro.09.031.2009
- ↑ Марков Д. (2021). Удалось увидеть, как в мозжечке личинок данио-рерио строятся модели взаимодействия тела с внешним миром / Элементы, 17.12.2021 // https://elementy.ru/novosti_nauki/433910/Udalos_uvidet_kak_v_mozzhechke_lichinok_danio_rerio_stroyatsya_modeli_vzaimodeystviya_tela_s_vneshnim_mirom
- ↑ Markov D. A., Petrucco L., Kist A. M., Portugues R. (2021). A cerebellar internal model calibrates a feedback controller involved in sensorimotor control / Nature Communications, Vol. 12, 2021 // https://doi.org/10.1038/s41467-021-26988-0
- ↑ Levy W. B., Steward O. (1983). Temporal contiguity requirements for long-term associative potentiation/depression in the hippocampus / Neuroscience, Vol. 8, Iss. 4, April 1983, pp. 799—808 // https://doi.org/10.1016/0306-4522(83)90011-8
- ↑ Artola A., Brocher S., Singer W. (1990). Different voltage-dependent thresholds for inducing long-term depression and long-term potentiation in slices of rat visual cortex / Nature, Vol. 347, pp. 69—72 // https://doi.org/10.1038/347069a0
- ↑ Markram H., Gerstner W., Sjöström P. J. (2011). A history of spike-timing-dependent plasticity / Frontiers in synaptic neuroscience, 3, 4 // https://doi.org/10.3389/fnsyn.2011.00004
- ↑ Debanne D., Gahwiler B. H., Thompson S. M. (1994). Asynchronous pre- and postsynaptic activity induces associative long-term depression in area CA1 of the rat hippocampus in vitro / Proceedings of the National Academy of Sciences of the United States of America, Vol. 91 (3), pp. 1148—1152 // https://doi.org/10.1073/pnas.91.3.1148
- ↑ Malinow R. (1991). Transmission between pairs of hippocampal slice neurons: quantal levels, oscillations, and LTP / Science, Vol. 252, Iss. 5006, pp. 722—724 // https://doi.org/10.1126/science.1850871
- ↑ Verstraelen P., Van Dyck M., Verschuuren M., Kashikar N. D., Nuydens R., Timmermans J.-P., De Vos W. H. (2018). Image-Based Profiling of Synaptic Connectivity in Primary Neuronal Cell Culture / Frontiers in Neuroscience, 26 June 2018 // https://doi.org/10.3389/fnins.2018.00389
- ↑ Danielson E., Lee S. H. (2014). SynPAnal: Software for Rapid Quantification of the Density and Intensity of Protein Puncta from Fluorescence Microscopy Images of Neurons / PLoS One, Vol. 9 (12), e115298 // https://doi.org/10.1371/journal.pone.0115298
- ↑ Kashiwagi Y., Higashi T., Obashi K., Sato Y., Komiyama N. H., Grant S. G. N., Okabe S. (2019). Computational geometry analysis of dendritic spines by structured illumination microscopy / Nature Communications, Vol. 10, Article number: 1285 // https://doi.org/10.1038/s41467-019-09337-0
- ↑ Markram H., Sakmann B. (1995). Action potentials propogating back into dendrites triggers changes in efficacy of single-axon synapses between layer V pyramidal cells / Society for Neuroscience abstracts, Vol. 21.
- ↑ Markram H., Gerstner W., Sjöström P. J. (2011). A history of spike-timing-dependent plasticity / Frontiers in synaptic neuroscience, 3, 4 // https://doi.org/10.3389/fnsyn.2011.00004
- ↑ Song S., Miller K. D., Abbott L. F. (2000). Competitive Hebbian learning through spike-timing-dependent synaptic plasticity / Nature Neuroscience. Vol. 3, pp. 919—926 // https://doi.org/10.1038/78829
- ↑ Markram H., Gerstner W., Sjöström P. J. (2011). A history of spike-timing-dependent plasticity / Frontiers in synaptic neuroscience, 3, 4 // https://doi.org/10.3389/fnsyn.2011.00004
- ↑ Izhikevich E. M. (2007). Solving the distal reward problem through linkage of STDP and dopamine signaling / Cerebral Cortex, Vol. 17, pp. 2443—2452 // https://doi.org/10.1093/cercor/bhl152
- ↑ Frémaux N., Gerstner W. (2016). Neuromodulated spike-timing-dependent plasticity, and theory of three-factor learning rules / Frontiers in Neural Circuits, Vol. 9 // https://doi.org/10.3389/fncir.2015.00085
- ↑ Tavanaei A., Maida A. (2019). BP-STDP: Approximating backpropagation using spike timing dependent plasticity / Neurocomputing, Vol. 330, pp. 39—47 // https://doi.org/10.1016/j.neucom.2018.11.014
- ↑ Bengio Y., Mesnard T., Fischer A., Zhang S., Wu Y. (2017). STDP-compatible approximation of backpropagation in an energy-based model / Neural computation, Vol. 29, Iss. 3, pp. 555—577 // https://doi.org/10.1162/NECO_a_00934
- ↑ Millidge B., Tschantz A., Buckley C. L. (2020). Predictive coding approximates backprop along arbitrary computation graphs // https://arxiv.org/abs/2006.04182
- ↑ Mozafari M., Ganjtabesh M., Nowzari-Dalini A., Thorpe S. J., Masquelier T. (2019). Bio-Inspired Digit Recognition UsingSpike-Timing-Dependent Plasticity (STDP) and Reward-Modulated STDP in Deep Convolutional Networks / Pattern Recognition, Vol. 94, pp. 87—95 // https://doi.org/10.1016/j.patcog.2019.05.015
- ↑ Lee C., Panda P., Srinivasan G., Roy K. (2018). Training Deep Spiking Convolutional Neural Networks With STDP-Based Unsupervised Pre-training Followed by Supervised Fine-Tuning / Frontiers in Neuroscience, Vol. 12, 2018 // https://doi.org/10.3389/fnins.2018.00435
- ↑ Mozafari M., Kheradpisheh S. R., Masquelier T., Nowzari-Dalini A., Ganjtabesh M. (2018). First-Spike-Based Visual Categorization Using Reward-Modulated STDP / IEEE Transactions on Neural Networks and Learning Systems, Vol. 29, No. 12, pp. 6178—6190 // https://doi.org/10.1109/TNNLS.2018.2826721